
编者按
当前,免疫疗法已成为肿瘤治疗的一种主要方法,但仍有许多肿瘤可以逃避免疫疗法的治疗,尤其对恶性肿瘤前期或早期浸润性肿瘤如何逃避免疫检测知之甚少。结直肠癌(CRC) 因其高度免疫抑制的肿瘤微环境对免疫治疗反应不敏感。为了改进目前的免疫疗法,识别并了解这种免疫功能失调微环境的机制至关重要。
2024年2月28日,哈佛大学医学院Judith Agudo团队与麻省理工学院Ömer H. Yilmaz团队在Nature上联合发表了题为“SOX17 enables immune evasion of early colorectal adenomas and cancers”的最新研究,该研究利用结直肠癌类器官原位移植方法,发现促进肿瘤免疫逃逸的关键因子SOX17,揭示了SOX17在结直肠癌(CRC) 中被诱导表达从而促进Lgr5+细胞转化成免疫原性弱的Lgr5-细胞,同时也削弱了肿瘤细胞对IFNg的敏感性,抑制效应CD8+T细胞的浸润,从而形成了免疫抑制的肿瘤微环境,促进结直肠癌的发生和发展。
文章题目
SOX17 enables immune evasion of early colorectal adenomas and cancers
杂志:Nature(IF=64.8)
发表时间:2024.2.28
作者:Judith Agudo、Ömer H. Yilmaz等
单位:美国哈佛大学医学院、麻省理工学院
01、研究背景
结直肠癌(Colorectal Cancer,CRC),是一种原发性恶性肿瘤,包括结肠癌和直肠癌,在我国恶性肿瘤中发病率位居第2位、死亡率第4位,已成为严重威胁人类生命健康的公共卫生问题。目前,我国绝大部分结直肠癌均由结直肠腺瘤演变而来。
癌症的标志是避免免疫破坏,一些早期癌细胞会设法逃避这种免疫监视,从而发展成更晚期的肿瘤,即免疫逃逸。结直肠癌(CRC)的特点是具有高度免疫抑制的微环境,并会对免疫治疗产生耐药性。然而,在结直肠癌发展的早期阶段,这种免疫抑制环境是如何演变的,仍然知之甚少。因此,识别并调控这种免疫功能失调微环境的机制对改进当前结直肠癌(CRC)的免疫治疗方法至关重要。
在这里,为了理解早期结直肠癌(CRC)的过程,研究人员首次揭示了SOX17可使早期结直肠腺瘤和癌症实现免疫逃逸,并强调了阻断SOX17功能或其激活途径有望为癌症早期治疗带来新的方向和策略。
02、研究结果
1、SOX17在结直肠癌中被诱导
研究人员通过将结直肠癌(CRC) 类器官原位移植到小鼠结肠,模拟体内CRC从早期到晚期的演变过程。经过RNA-seq和ATAC-seq联合分析发现,体内结肠环境会诱发原发性CRC类器官衍生体发生稳定的、可遗传的转录组和表观遗传变化,且SOX17转录因子的染色质可及性和转录水平都显著上调,IHC染色也证实了组学分析的发现。
实验结果表明,在小鼠体内结肠环境中移植CRC类器官导致SOX17转录因子的表达上调。
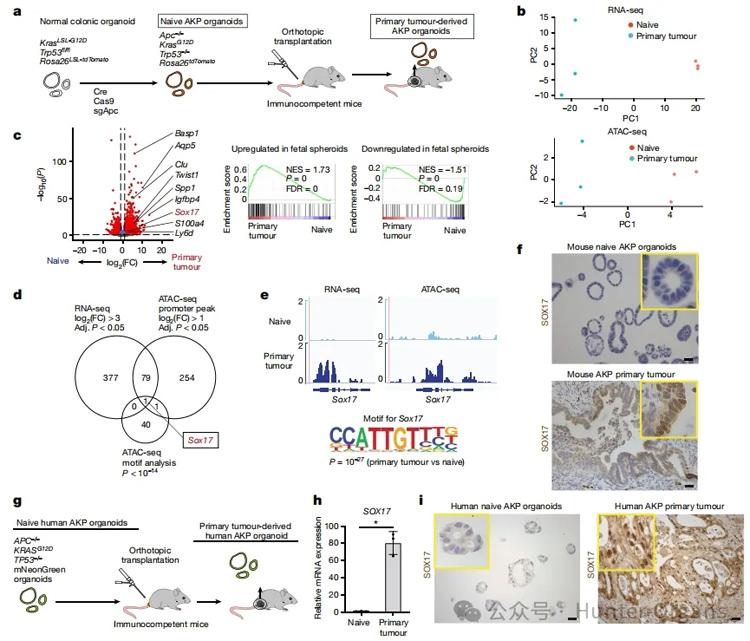
图1
2、SOX17抑制免疫清除
随后,研究人员对SOX17在CRC演变过程中的作用进行了研究。通过CRISPR-Cas9在CRC类器官中敲除Sox17基因,再进行移植手术,发现SOX17的缺失导致只有6%的荷瘤小鼠,且肿瘤体积减小,肿瘤组织中免疫细胞浸润增加;而野生型CRC类器官移植小鼠免疫浸润表型刚好相反,且SOX17缺失不影响免疫缺陷小鼠肿瘤的发生。
与之前的报道一致,对照组AKP肿瘤浸润不良且为“免疫冷”(图2h、i),而少数存活的SOX17-null肿瘤显示出强大的肿瘤内免疫细胞浸润,包括许多CD4+和CD8+T细胞(图2h、i)。为了进一步验证SOX17在体内的表达可能抑制抗肿瘤免疫反应,研究人员将SOX17-null AKP类器官移植到有免疫缺陷的NCG小鼠或Rag2-/-小鼠中,发现与对照组相比,所有受体小鼠均出现肿瘤,肿瘤大小没有显著差异(图2k,l),这表明SOX17在体内通过抑制免疫清除促进肿瘤的发展。
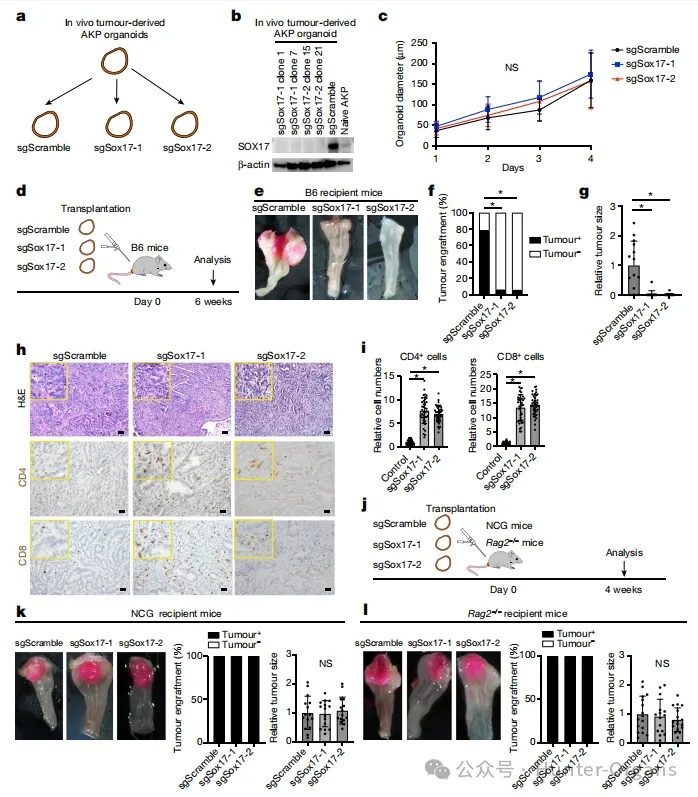
图2
3、SOX17 抑制IFNγ信号传导
在内源性Apc缺失的恶性肿瘤和类器官移植衍生的AKP结直肠癌中,SOX17都会抑制干扰素-γ(IFNγ),阻止抗肿瘤T细胞的反应,因此,IFNγ被看作是免疫系统对抗癌细胞的重要标志之一。
为了进一步研究肿瘤细胞中的SOX17如何调控肿瘤相关免疫环境的变化,研究人员采用scRNA-seq对SOX17缺失和野生型CRC类器官移植的小鼠T细胞进行重新聚类。在对照肿瘤中,终末期耗尽的CD8+T细胞构成了第4周时CD8+T细胞的主要群体(29%);而具有较强抗肿瘤杀伤能力的效应性CD8+T细胞成为中数量最多的。相反,这种细胞毒性群体仅在对照肿瘤稀疏检测到,与CRC的免疫抑制环境一致。流式细胞术分析证实,与对照肿瘤相比,SOX17缺失肿瘤中CD8+T细胞产生IFNγ和TNF的能力显著增强。
随后,研究人员对CD8+和CD4+T细胞在肿瘤中介导SOX17效应进行研究,发现CD8+T细胞耗竭使所有SOX17缺失的肿瘤生长(图3h-j),表明在免疫正常的小鼠中,SOX17缺失的肿瘤被CD8+T细胞清除。与CD8+T细胞缺失的小鼠相比,CD4+T细胞缺失的小鼠肿瘤体积明显较小。这些数据表明,SOX17缺失的肿瘤中,TH1细胞可能支持CD8+T细胞介导的抗肿瘤反应。综上所述,实验结果表明,效应性CD8+T细胞激活了对SOX17缺失肿瘤的排斥反应,而CD4+T效应性TH1细胞在维持和增强CD8+T细胞反应中发挥了重要作用。
为了研究SOX17在结肠癌细胞中抑制IFNγ信号的机制,研究人员通过使用中和IFNγ的抗体或IFNAR1的抗体处理小鼠比较肿瘤的移植成活率,结果显示SOX17直接抑制Ifngr1的表达,SOX17敲除的肿瘤表现出增强的IFNγ反应,IFNγ的中和抗体显著增强了肿瘤的移植成活率,这表明SOX17通过抑制癌细胞中IFNγ级联信号中关键基因的表达,有效阻止抗肿瘤CD8+T细胞反应的形成,从而保护结肠癌不被免疫清除。
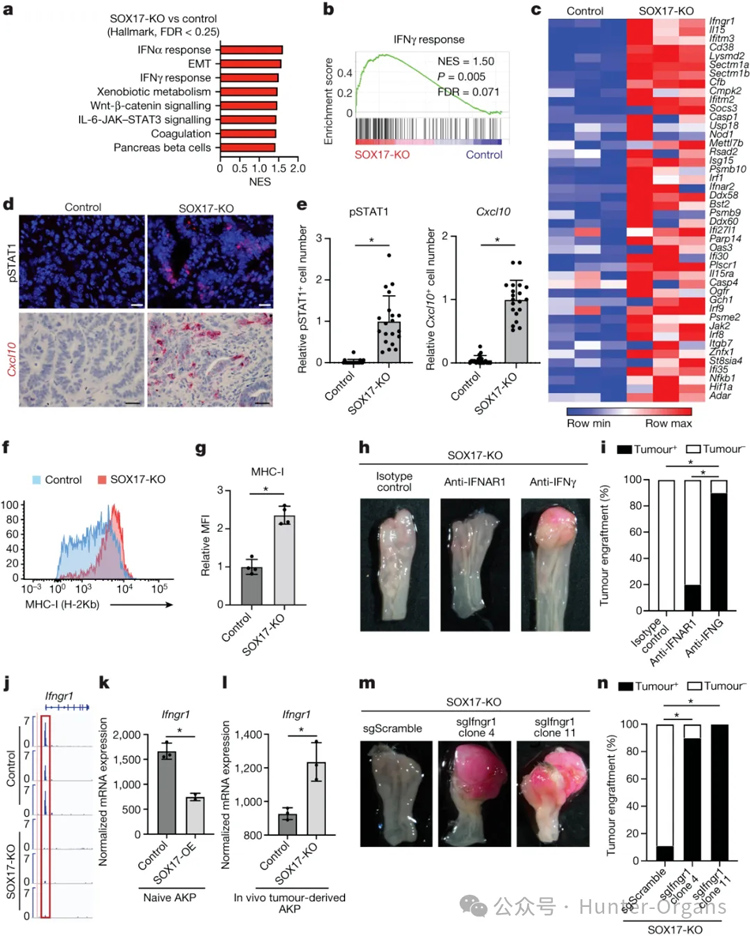
图3
4、SOX17促进肿瘤免疫逃逸
LGR5+肠道干细胞中的APC的缺失诱发癌前腺瘤形成的级联反应。为了评估SOX17在早期结直肠癌的必要性,研究人员同时抑制小鼠体内LGR5+肠道干细胞中的APC和SOX17,发现Apc敲除小鼠有效形成了腺瘤,SOX17的缺失显著降低了肿瘤负荷,这表明SOX17在肿瘤形成中具有重要作用,且SOX17的表达与CD8+T细胞和CD4+细胞的存在呈负相关。
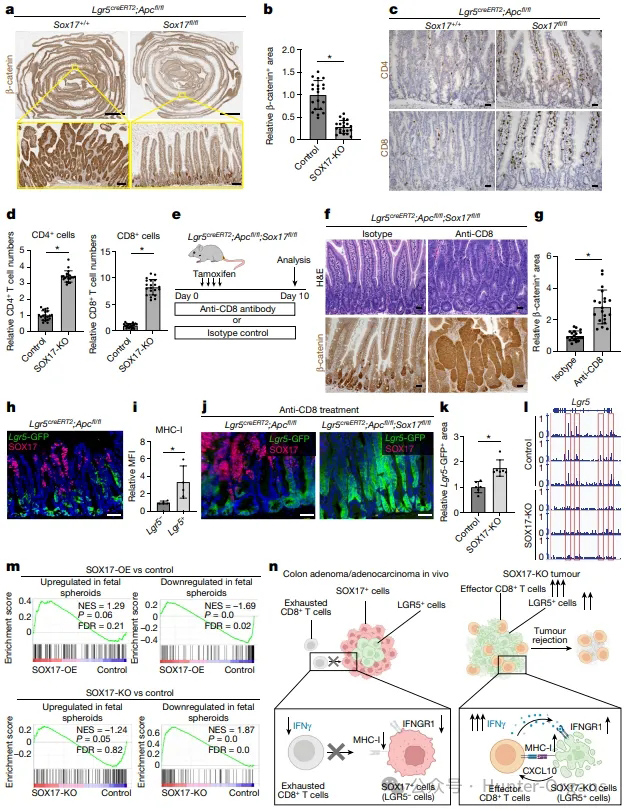
图4
03、编者点评
综上,本研究发现SOX17是一种转录因子,在肿瘤早期阶段中发挥着重要作用,不仅可以在体内介导肿瘤的表观遗传重编程,产生LGR5-细胞,而且可以抑制CRC对IFNγ的信号传导,并促进早期结肠癌肿瘤的免疫逃逸。当SOX17在癌细胞中被激活时,它会帮助细胞创造一个免疫抑制环境,因此,阻断SOX17功能或其激活途径来阻断结直肠癌的发生发展,有望为早期癌症治疗带来新的方向和策略。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型及脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
